2020年10月1日起,首批实施医疗器械唯一标识的医疗器械企业所有销售的产品必须具有具有医疗器械唯一标识,否则不得上市。
2019年7月1日,国家药品监督管理局(NMPA)会同国家卫生健康委联合印发了《医疗器械唯一标识系统试点工作方案》,8月26日,国家药监局发布了《医疗器械唯一标识系统规则》,10月14日印发《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》,2020年10月1日起,列入首批实施目录的医疗器械将正式开始实施医疗器械唯一标识。中国医疗器械唯一标识系统工作正式进入有法可依、有章可循、分步实施、组织保障的新阶段。
实施医疗器械唯一标识后,医疗器械的注册人和备案人在生产医疗器械时,应当选择适当的载体形式将医疗器械唯一标识赋在产品的本体或其包装上。按国家药品监督管理局最新数据,目前注册/备案的医疗生产企业总共有26595家,首批试点116家器械生产企业。未来几年喷码标识在医疗器械唯一标识应用将呈现出巨大商机。
随着信息化的发展和医疗事业的不断进步,人们对医疗器械安全性的关注度越来越高,如何让医疗设备生产企业、医院、病人、监管部门了解治疗所使用的医疗设备、药品情况及核心属性;出现医疗产品错误,如何及时实施追溯、精准召回,减少医疗事故是全球医务患者面对的共同问题,而推广医疗器械唯一标识,成为解决此类问题的最佳选择,同时,这也是全球医疗器械市场国际化发展的必然趋势。
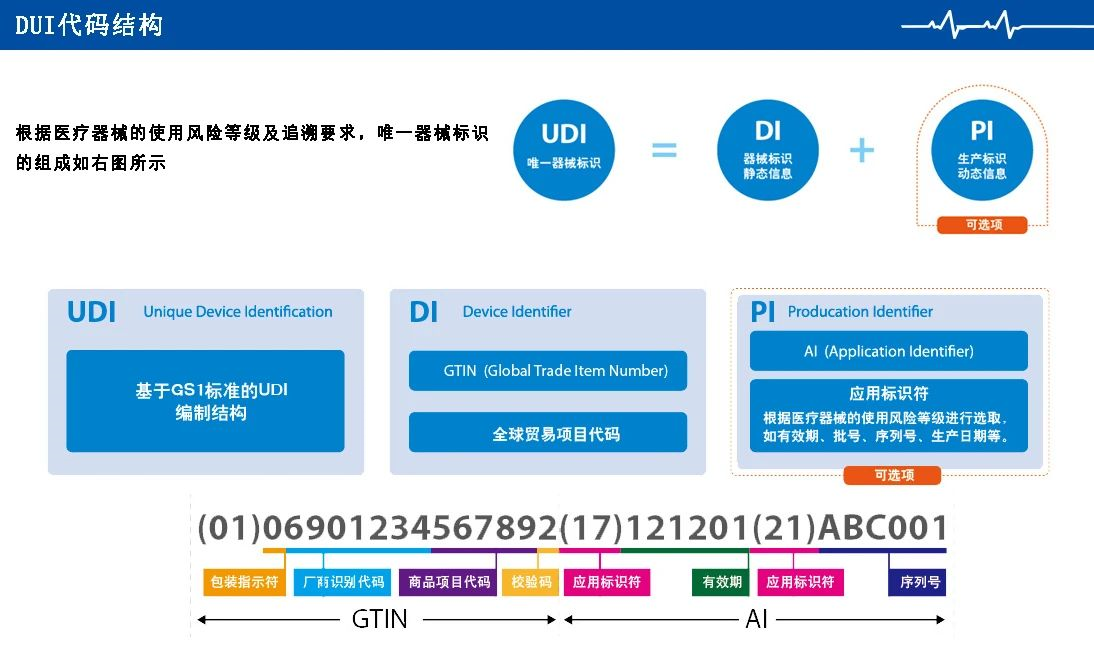
医疗器械唯一标识(Unique Device Identification,缩写UDI)由器械识别码(DI)和生产识别码(PI)组成,是对医疗器械在其整个生命周期赋予的身份标识,是其在产品供应链中的唯一“身份证”。器械识别码是强制固定的编码,包含了标签管理人员的信息、设备特定版本或型号,而生产识别码不受特别规定,包含了器械生产批号、序列号、生产日期、失效日期以及作为器械管理产品的特有识别码。
近年来,全球医疗器械唯一标识工作在不断推进,2013年,国际医疗器械监管机构论坛(IMDRF)、美国FDA分别发布相关医疗器械唯一标识系统指南及法规;2014年,美国FDA率先对第三类医疗器械实施医疗器械唯一标识。此后,欧盟明确了实施医疗器械唯一标识的法规要求,日本、澳大利亚等国家也陆续开展相关工作。在时下抗击新型冠状病毒“抗疫战”中,疫情防控的医疗设备需求更是大大加速了UDI的使用进程。
UDI唯一标识的数据载体有:一维码、二维码和射频标签(RFID)。一维码应用多年已经很成熟,成本低,能很好兼容市面上现有的扫码设备,但一维码所占空间大,破损纠错能力差。二维码相比于一维码,相同空间能够容纳更多的数据,在医疗器械包装尺寸受限的时候能发挥很好的作用,具备一定的纠错能力。射频标签的载体成本和识读设备成本相较于一维码和二维码要高,但射频标签读取速度快,可以实现批量读取,在某些环节和领域能够发挥作用。注册人/备案人可根据产品的特征、价值、主要应用场景等因素选择适当的医疗器械唯一标识数据载体。


